CCM(脑海绵状血管瘤)家族在三个染色体基因位点(CCM1,CCM2,CCM3)中表现出孟德尔遗传。通过连锁、单倍型和突变分析,CCM1基因被定位为克隆,主要是在7q11.2-q21区域和一个常见的突变CCM1编码KRIT1(Krev相互作用捕获1)蛋白质。该CCM1基因由跨越45,799个碱基对(bp)的20个外显子组成,并映射到7q11.2-q21区域。翻译的起点似乎是外显子5,超过88个不同的种系突变分布在整个CCM1的许多不同种族中,基因被描述为与CCM有关。到目前为止,所描述的所有可能都会导致CCM1蛋白断短。CCM1在明显散发的CCM1病例中发现了多种突变。
MGC4607最近在9个与CCM2基因座连锁的家庭中发现了8种不同的突变。
伤害发生的两击假设。
两种不同的体细胞突变CCM1在从无疾病家族史、携带单个CCM的患者手术切除的病变中分离出来,支持病变的双重假设。赖克等人进行的另一项研究。CCM1体细胞突变未能在72个石蜡包埋的CCM病变中识别,说明体细胞突变的作用需要进一步研究。在二次攻击模型中,一个血管细胞有两个突变(生殖系统或体细胞),导致功能性CCM1蛋白完全丧失,克隆扩张形成CCM病变。据推测,家族病例中发现的多个CCM病变是由每个细胞中发现的同一个突变和不同的体细胞突变引起的。多发性病变不会是转移的结果。家族CCM表现出常染色体显性遗传模式,但在细胞水平上可能是隐性的,病变可能需要两次攻击同一个基因。
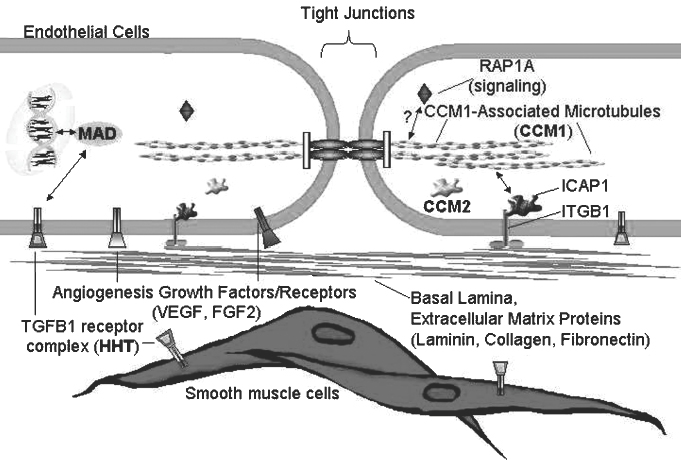
由于CCM1基因的识别,研究集中在CCM1蛋白质的功能特性上。基于与已知蛋白质的序列相同的来源,以及用酵母双杂交筛选的蛋白质蛋白质分析,预测了三个功能领域。建立双杂交系统是通过测色试验或生长选择来检测报告基因的转录。报告基因转录取决于与目的基因融合的DNA结构领域和与可能与目的基因相互作用的许多不同基因融合的转录激活结构领域的关系。当酵母菌落生长或变蓝时,表明含有目的基因的融合蛋白与含有激活结构的融合蛋白之一相互作用,允许报告基因转录,蛋白质与蛋白质相互作用被识别。NPXY基础在CM1氨基末端明显与集成素结构领域相关,表明CCM1是集成信号通路的一部分(集成素信号通路的一部分(与β特异性结合)和集成,集成,集成蛋白质与其他人体内部分(与β-蛋白质)与其他人体内部分相关联,集成。CCM1CM1蛋白质与其他人体内部分(CM1蛋白质相关,集成体内部分集成体内部分集成。CM1蛋白质与其他组织结构领域集成体内部分集成在一体内部分集成,集成在一体内部分集成在一体内部分集成在一体内部分集成在一体内部分集成。CCM1CM1蛋白质内部分集成在一体内部分(CM1蛋白质内部分集成在一体内部分集成在一体内部分集成,集成在一体内部分集成在一体内部分集成在一体内部分集成。CM1蛋白质内部分集成在一体内部分集成在一体内部分集成在一体内部分集成体内部分集成在一体内部分集成在一体内部分集成在一体内部分集成
Whitehead等人使用鼠基因目标证明CCM1是血管发育所必需的,KRIT1相关的血管缺陷不是继发于破坏的神经模式,而是继发于动脉同一性建立中重要破坏的遗传途径。
该CCM2基因编码是一种与磷酸酪氨酸结合的蛋白质,类似于ICAP,可能通过类似的机制导致CCM的形成形成,它涉及到整合素介导细胞间紧密连接的调节变化。
多数CCM患者(50%-80%)显然是散发性的,没有已知的CCM家族史。大约75%的散发病例和8-19%的家族病例可以发现单个CCM病例。202例CCM1突变病例发现,13%有单个CCM病变,2.5%无法检测到的病变使用T2加权磁共振成像。多灶性病变的存在显示了家族形式的CCM。相反,孤立性病变和与VM有关的病变不太可能与家族性疾病有关。
家族细胞间粘附分子与可能影响内皮细胞骨架的基因缺陷有关,可能导致内皮细胞间粘附缺陷和毛细血管增殖不完全成熟。
散发性疾病很可能反映了疾病本身中相同基因的破坏(体细胞突变)或相同分子途径的破坏,导致相似的信号变化,最终导致与家族病例中相同的病变表现。所以,家族病例的遗传故事可以成为揭示家族性分子途径的关键,也可以成为偶发性疾病。